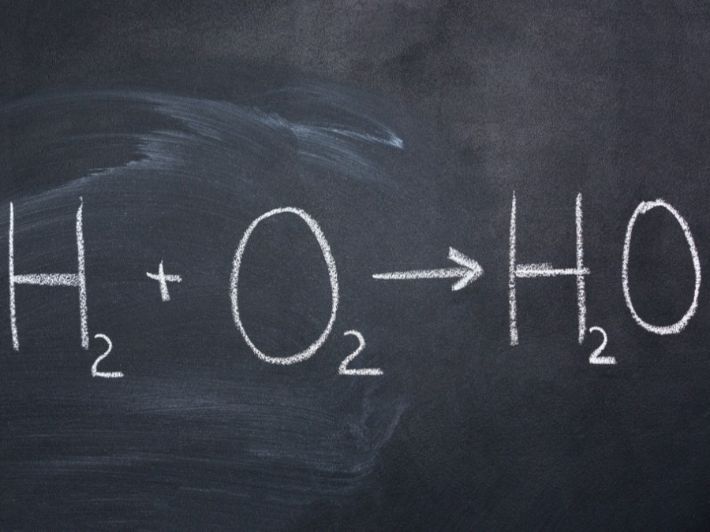
يُعتبر حل المعادلة كهرباء وماء من المواضيع الأساسية في الكيمياء الكهربية، حيث يعتمد على تحليل الماء كهربائيًا لتفكيكه إلى مكوناته الأساسية: الهيدروجين والأكسجين. هذا التفاعل يُعرف بتحليل الماء كهربائيًا أو التحليل الكهربي للماء، وهو عملية فيزيائية مهمة تدخل في العديد من التطبيقات الصناعية والعلمية. في هذا المقال، سنستعرض بالتفصيل كيفية حل هذه المعادلة، وفهم المعادلات الكيميائية المرتبطة بها، بالإضافة إلى شرح شامل للجهاز المستخدم في هذه العملية وتأثير تحليل الماء المحمض كهربائيًا.
معادلة تفكك الماء
عند تمرير تيار كهربائي في الماء، يتم تفكيكه إلى غازي الهيدروجين والأكسجين وفقًا للتفاعل التالي:
المعادلة الكيميائية لتحليل الماء:
2H2O(l)→2H2(g)+O2(g)2H_2O(l) \rightarrow 2H_2(g) + O_2(g)
التفسير العلمي:
- الكاثود (القطب السالب): يتجمع غاز الهيدروجين (H₂).
- الأنود (القطب الموجب): يتجمع غاز الأكسجين (O₂).
- تتطلب هذه العملية وجود إلكتروليت مثل حمض الكبريتيك المخفف أو هيدروكسيد الصوديوم لتسهيل توصيل التيار الكهربائي.
معادلة الماء H2O
الماء يتكوّن من عنصرين أساسيين: الهيدروجين والأكسجين. الصيغة الكيميائية للماء هي:
H2OH_2O
وهذا يعني أن كل جزيء ماء يحتوي على ذرتين من الهيدروجين وذرة واحدة من الأكسجين.
جهاز فصل مكونات الماء
لإجراء عملية التحليل الكهربي للماء، يتم استخدام جهاز مخصص يُسمى جهاز التحليل الكهربي للماء.
مكونات الجهاز:
- وعاء زجاجي يحتوي على الماء الممزوج بالإلكتروليت.
- مصدر كهربائي يوفر تيارًا مستمرًا.
- قطبان كهربائيان (كاثود وأنود) مصنوعان من مادة موصلة مثل البلاتين أو الجرانيت.
- أنابيب لجمع الغازات الناتجة عن التحليل.
آلية العمل:
- يتم توصيل القطبين بمصدر التيار الكهربائي.
- يتجمع غاز الهيدروجين عند الكاثود وغاز الأكسجين عند الأنود.
- تكون كمية غاز الهيدروجين المتجمعة ضعف كمية الأكسجين نتيجة للنسبة في صيغة الماء.
تحليل الماء كيميائيًا
التحليل الكيميائي للماء يعني تفكيكه إلى مكوناته الأساسية. وهذا يتم عادةً عبر:
الطرق الكيميائية لتحليل الماء:
- التحليل الكهربائي: كما وضحنا سابقًا.
- التفاعل مع المعادن النشطة: مثل تفاعل الصوديوم أو البوتاسيوم مع الماء، حيث يتكون هيدروكسيد الصوديوم وغاز الهيدروجين.
مثال على التفاعل الكيميائي:
2Na+2H2O→2NaOH+H22Na + 2H_2O \rightarrow 2NaOH + H_2
جدول التحليل الكهربائي للماء
يمكن توضيح نواتج التحليل الكهربائي للماء عبر جدول بسيط:
| القطب | التفاعل | المنتج |
|---|---|---|
| الكاثود (-) | 2H++2e−→H22H^+ + 2e^- \rightarrow H_2 | هيدروجين |
| الأنود (+) | 2H2O→O2+4H++4e−2H_2O \rightarrow O_2 + 4H^+ + 4e^- | أكسجين |
ماذا يحدث عند تحليل الماء المحمض كهربائيًا؟
عند إضافة حمض إلى الماء مثل حمض الكبريتيك المخفف، تزداد موصلية الماء، مما يُسهل عملية التحليل الكهربائي.
التأثيرات:
- زيادة سرعة التحليل: بسبب وفرة الأيونات.
- نقاء الغازات الناتجة: إذ لا يتفاعل الحمض مع الغازات المنتجة.
- تقليل استهلاك الطاقة: لأن الحمض يُحسن من انتقال التيار الكهربائي.
أسئلة قد تهمك
1. لماذا لا يتحلل الماء النقي بسهولة كهربائيًا؟
الماء النقي موصل ضعيف للكهرباء، لذا يُضاف إليه إلكتروليت (مثل حمض الكبريتيك) لتسهيل التحليل الكهربائي.
2. ما الغاز الذي يتجمع أكثر عند تحليل الماء؟
غاز الهيدروجين يتجمع بمعدل ضعف غاز الأكسجين بسبب نسبة العناصر في الماء (H₂O).
3. هل التحليل الكهربائي للماء آمن؟
نعم، لكنه يحتاج إلى إشراف دقيق لأن غاز الهيدروجين قابل للاشتعال.
4. ما استخدامات غازي الهيدروجين والأكسجين الناتجين؟
- الهيدروجين: يُستخدم كوقود نظيف في خلايا الوقود.
- الأكسجين: يُستخدم في الأغراض الطبية والصناعية.
5. هل يمكن تحليل الماء دون إضافة إلكتروليت؟
يمكن ذلك، لكن العملية ستكون بطيئة جدًا بسبب ضعف التوصيل الكهربائي للماء النقي.
التعليقات